Leerdoelen
- Bepaal de gevoeligheid van verschillende bacteriesoorten voor verschillende antibiotica en synthetische middelen.
Een echt antibioticum is een antimicrobiële chemische stof die door micro-organismen tegen andere micro-organismen wordt geproduceerd. De mensheid heeft in haar strijd tegen besmettelijke ziekten zeer goed gebruik gemaakt van deze antimicrobiële stoffen. Veel geneesmiddelen zijn nu volledig synthetisch of het natuurlijke geneesmiddel wordt gemanipuleerd om de structuur ervan enigszins te veranderen, de laatste worden semisynthetica genoemd. Bacteriën reageren verschillend op antibiotica en chemosynthetische geneesmiddelen, zelfs binnen dezelfde soort. Staphylococcus aureus bijvoorbeeld is een veel voorkomende bacterie van de normale flora die in het lichaam wordt aangetroffen. Als men deze bacterie bij 5 verschillende mensen zou isoleren, zouden de 5 isolaten waarschijnlijk verschillende stammen zijn, d.w.z. genetisch licht verschillend. Het is ook waarschijnlijk dat als men antibiotica-gevoeligheidstests op deze isolaten zou uitvoeren, de resultaten zouden variëren tegen de verschillende gebruikte antibiotica.
De Kirby-Bauer-test voor antibiotica-gevoeligheid (ook wel de disc-diffusietest genoemd) is een standaard die al jaren wordt gebruikt. Hij werd voor het eerst ontwikkeld in de jaren vijftig en verfijnd door W. Kirby en A. Bauer, en vervolgens gestandaardiseerd door de Wereldgezondheidsorganisatie in 1961. In klinische laboratoria is hij vervangen door geautomatiseerde tests. De K-B wordt echter in sommige laboratoria nog gebruikt, of met bepaalde bacteriën waar de automatisering niet goed mee werkt. Deze test wordt gebruikt om de resistentie of gevoeligheid van aëroben of facultatieve anaëroben voor specifieke chemische stoffen te bepalen, die vervolgens door de clinicus kunnen worden gebruikt voor de behandeling van patiënten met bacteriële infecties. De aan- of afwezigheid van een remmend gebied rond de schijf identificeert de gevoeligheid van de bacterie voor het geneesmiddel (figuur
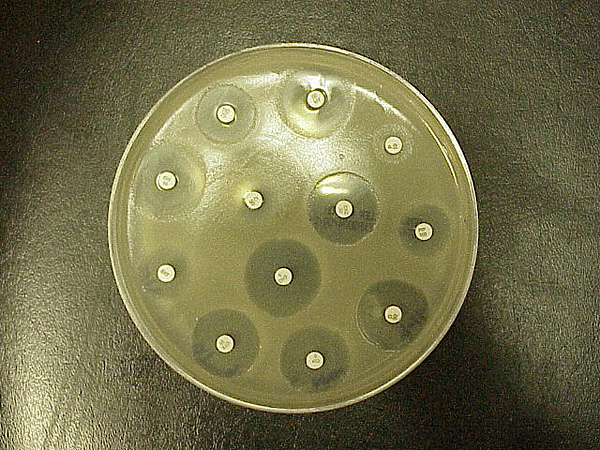
De basis is eenvoudig: de bacterie wordt op de agar geveegd en de antibioticaschijven worden erop geplaatst. Het antibioticum diffundeert van het schijfje in de agar in afnemende hoeveelheden naarmate het verder van het schijfje verwijderd is. Als het organisme door de concentratie van het antibioticum wordt gedood of geremd, zal er in de onmiddellijke omgeving van het schijfje GEEN groei zijn: Dit wordt de remmingszone genoemd (figuur 9.1). De grootte van de zone wordt op een gestandaardiseerde grafiek opgezocht om een resultaat te krijgen van gevoelig, resistent of intermediair. Veel kaarten hebben een bijbehorende kolom die ook de MIC (minimale remmende concentratie) voor dat geneesmiddel geeft. De MIC is momenteel de standaardtest voor antibiotica-gevoeligheidstests, omdat deze meer relevante informatie over minimale doseringen oplevert.
Het Mueller-Hinton-medium dat voor de Kirby-Bauer-test wordt gebruikt, is zeer eiwitrijk.
MATERIALEN NODIG: per tabel
- 2 Mueller-Hinton agar-platen
- 24 uur oude culturen (waarschijnlijk Staph, E. coli, Bacillus subtilus, Enterococcus fecalis) steriele swabs
- antibiotica
- ethanol
- forceps
- richtlijnenkaart voor interpretatie van antibioticagevoeligheid
Pseudomonas aeruginosa Kirby-Bauer-plaat voor demo
DE PROCEDURES
2e swab-dekking ►

- Swab een Mueller-Hinton-plaat met ENKEL 2 van de bacteriën (in de tabellen worden verschillende combinaties van de 4 bacteriën gebruikt). Doop een steriel wattenstaafje in de bouillon en druk overtollig vocht uit door het wattenstaafje tegen de zijkant van het buisje te drukken.
- Doe het oppervlak van de agar helemaal schoon (je wilt helemaal geen agarvlakjes overhouden die niet zijn schoongeveegd). In de foto’s hieronder kunt u zien wat er gebeurt als de plaat niet correct wordt gezwabberd met een gelijkmatige dekking van de bacterie over de hele agar.
- Nadat de plaat volledig is gezwabberd, draait u deze 90 graden en herhaalt u het zwabberproces. (Het is niet nodig om het wattenstaafje opnieuw te bevochtigen.) Laat het wattenstaafje rond de omtrek van de plaat lopen voordat u het in de weggooizak weggooit.
- Laat het oppervlak ongeveer 5 minuten drogen voordat u antibioticaschijven op de agar plaatst.
- DE ANTIBIOTISCHE SCHIJVEN:
- U gebruikt individuele antibioticadispensers.
-
 U zult waarschijnlijk een tang moeten gebruiken om een antibioticaschijfje uit de dispenser te halen: de tang moet steriel zijn. Leg de tang in alcohol, steek de tang in de vlam tot hij vlam vat, laat de vlam doven—-steriele tang.
U zult waarschijnlijk een tang moeten gebruiken om een antibioticaschijfje uit de dispenser te halen: de tang moet steriel zijn. Leg de tang in alcohol, steek de tang in de vlam tot hij vlam vat, laat de vlam doven—-steriele tang. - Raak elk schijfje lichtjes aan met uw steriele inoculatielus om ervoor te zorgen dat het goed in contact komt met het agaroppervlak. Incubeer omgekeerd en bij 37o C.
INTERPRETATIE
-
 Plaats de metrische liniaal over de remmingszone, op de breedste diameter, en meet van de ene rand van de zone naar de andere rand. De plaat tegen het licht houden kan helpen.
Plaats de metrische liniaal over de remmingszone, op de breedste diameter, en meet van de ene rand van de zone naar de andere rand. De plaat tegen het licht houden kan helpen. - Gebruik millimeter metingen. De schijfdiameter maakt deel uit van dat getal.
- Als er helemaal geen zone is, rapporteer die dan als 0 – ook al is de schijf zelf ongeveer 7 mm.
- De zone-diameter wordt gerapporteerd in millimeters, opgezocht op de kaart, en het resultaat gerapporteerd als gevoelig, resistent, of gemiddeld.
- Registreer de resultaten voor uw tabel, evenals voor andere tabellen, in de tabel.
|
Antibioticum (antimicrobieel middel) |
DISC CODE |
Resistent (< of = mm) |
Intermediate (mm) |
Vervaardig (= of > mm) |
|
|---|---|---|---|---|---|
| Amoxicilline (anders) | AMC | <13 | 14-17 | mm)” style=”text-uitlijnen:midden;” class=”lt-bio-3483″>>18 | |
| Amoxicilline (Staph) | AMC | 19 | mm)” style=”text-uitlijnen:midden;” class=”lt-bio-3483″>20 | ||
| Ampicilline (overige) | AM | 11 | 12-13 | mm)” style=”text-uitlijnen:midden;” class=”lt-bio-3483″>14 | |
| Ampicilline (Staph) | AM | 28 | mm)” style=”text-uitlijnen:midden;” class=”lt-bio-3483″>29 | ||
| Carbenicilline (overige) | CB | 17 | 18- | 17 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>23 |
| Carbenicilline (Pseudomonas) | CB | 13 | 14-16 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>17 | |
| Cefoxitin | FOX | 14 | 15-.17 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>18 | |
| Cephalothin | CF | 14 | 15-.17 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>18 | |
| Chloramphenicol | C | 12 | 13-17 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>18 | |
| Ciprofloxacin | CIP-5 | 15 | 16-20 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>21 | |
| Clindamycin | CC-2 | 14 | 15-20 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>21 | |
| Enoxacin (Fluoroquinolone, 2e gen.) | ENX-10 | 14 | 15-17 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>18 | |
| Erthromycine | E | 13 | 14-.22 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>23 | |
| Gentamycin | GM | 12 | 13-.14 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>15 | |
| Kanamycine | K-30 | 13 | 14-17 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>18 | |
| Methicilline (Staph) | M(orDP) | 9 | 10-13 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>14 | |
| Oxacilline (Staph) | OX | 10 | 11-12 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>13 | |
| Penicilline G (Enterococcus) | P | 14 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>15 | ||
| Penicilline G (Staph) | P | 28 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>29 | ||
| Streptomycine | S-10 | 14 | 15-20 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>21 | |
| Sulfamethoxazol-trimethoprim | SXT | 10 | 11-15 | mm)” style=”text-align:midden;” class=”lt-bio-3483″>16 | |
| Tetracycline | Te-…30 | 14 | 15-18 | mm)” style=”text-align:center;” class=”lt-bio-3483″>19 | |
| Tobramycine | NN-.10 | 12 | 13-14 | mm)” style=”text-align:center;” class=”lt-bio-3483″>15 | |
| Vancomycine | Va-30 | 9 | 10-11 | mm)” style=”text-align:center;” class=”lt-bio-3483″>12 |
TABEL VOOR RESULTATEN
Registreer de resultaten voor de 5 bacteriën met alle antibiotica.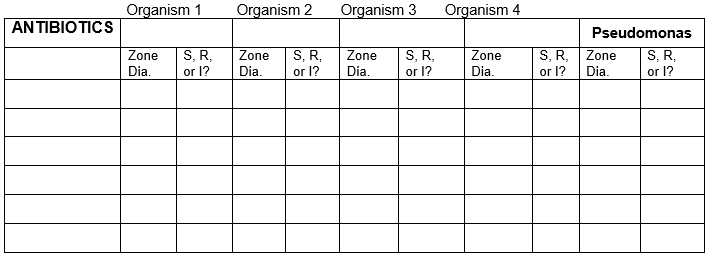
Zone-diameter in millimeter-eenheden. Gebruik de grafiek voor gevoelig, resistent of intermediair
VRAGEN
- Hoe groter de zone-grootte, hoe meer ____________ de bacterie is voor dat antibioticum.
- Welke meeteenheden worden gebruikt om de zone-grootte te meten?
- Hoe verhoudt de gevoeligheid van de Staph zich tot de gevoeligheid van de Pseudomonas?
Bijdragers
-
Jackie Reynolds, hoogleraar biologie (Richland College)