Enkele covalente bindingen
De eenvoudigste covalente binding wordt gevormd tussen twee waterstofatomen. Elk waterstofatoom heeft een enkel elektron, en elk heeft twee elektronen nodig voor een volle buitenste schil. De waterstofmolecule bestaat uit twee waterstofatomen die hun twee valentie-elektronen delen. Waterstof kan ook covalente bindingen vormen met andere atomen. Bijvoorbeeld, waterstof en chloor hebben elk een extra elektron nodig om een edelgasconfiguratie te bereiken. Door valentie-elektronen te delen (elk atoom staat er een af) ontstaat het stabiele molecuul HCl.
We zullen een vereenvoudigde weergave van covalente bindingen gebruiken die bekend staat als Lewisstructuren. Deze tekeningen zijn ook bekend onder verschillende andere namen, waaronder Lewis punt structuren of elektron punt structuren. Elk punt in de structuur vertegenwoordigt een valentie-elektron in de verbinding. Bijvoorbeeld, ²(²H_2}²) kan worden getekend als ²(²ce{H} : ²ce{H}}). Elk punt staat voor één valentie-elektron, en het feit dat ze tussen de twee atomen staan betekent dat ze gedeeld worden in een covalente binding. Voor grotere moleculen kan het lastig worden om alle valentie-elektronen uit te tekenen, dus kan een bindingspaar elektronen ook als een rechte lijn worden getekend. Zo kan de binding (H_2) ook worden weergegeven als de binding (H-H).
Als we de Lewisstructuur van \ce{HCl}} zouden willen laten zien, dan zouden we het volgende tekenen:

We zien dat de covalente binding bestaat uit twee elektronen tussen de \ce{H}} en de \ce{Cl}}. Het chloor heeft een volledige buitenste schil van twee elektronen en het chloor heeft een volledige buitenste schil van acht elektronen. Covalente bindingen met andere halogenen kunnen op dezelfde manier worden geschreven.
Dergelijke Lewis-structuren kunnen ook worden geschreven voor andere moleculen die covalente bindingen vormen. Veel verbindingen die covalente bindingen bevatten worden bij elkaar gehouden door covalente bindingen. Het aantal covalente bindingen dat een atoom zal vormen kan over het algemeen worden voorspeld aan de hand van het aantal elektronen dat een atoom nodig heeft om zijn valentieschil te vullen. Bijvoorbeeld, zuurstof heeft 6 elektronen in zijn buitenste schil en heeft er nog twee nodig om deze schil te vullen, dus zal het slechts twee covalente bindingen vormen met andere atomen. Als we naar de watermolecule kijken (links, rechts, enz.) (zie onderstaande figuur), zien we dat het zuurstofatoom in totaal twee bindingen maakt (één met elk waterstofatoom).
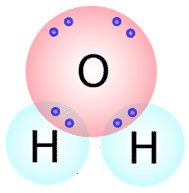
Zoals je kunt zien, zijn er twee elektronenparen die niet betrokken zijn bij covalente binding. Deze ongebonden elektronenparen staan bekend als lone pairs en dragen bij aan de algemene vorm van het molecuul. Op dezelfde manier heeft stikstof drie elektronen nodig om zijn valentieschil te completeren, dus heeft het de neiging om drie covalente bindingen te maken, met nog één paar niet-gebonden elektronen over.
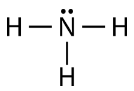
Ook hier staat elk van de lijnen voor een paar bindende elektronen (een enkele binding), en is het eenzame paar van stikstof getekend als twee stippen.