Leerdoelen
- Het verband tussen de concentratie van opgeloste stoffen en de fysische eigenschappen van een oplossing beschrijven.
- Begrijpen dat het totale aantal niet-vluchtige opgeloste deeltjes de daling van de dampspanning, de stijging van het kookpunt en de daling van het vriespunt van een oplossing bepaalt ten opzichte van het zuivere oplosmiddel.
Osmosedruk is een colligatieve eigenschap van oplossingen die wordt waargenomen met behulp van een semipermeabel membraan, een barrière met poriën die klein genoeg zijn om moleculen van oplosmiddelen door te laten, maar geen moleculen van oplosmiddelen of ionen. De nettostroom van oplosmiddel door een semipermeabel membraan wordt osmose genoemd (van het Griekse osmós, dat “duwen” betekent). De richting van de nettostroom van het oplosmiddel is altijd van de kant met de lagere concentratie van het oplosmiddel naar de kant met de hogere concentratie.
Osmose kan worden gedemonstreerd met behulp van een U-buisje zoals dat in figuur {PageIndex{1}}, dat zuiver water in de linkerarm en een verdunde waterige oplossing van glucose in de rechterarm bevat. Er vindt een nettostroom van water door het membraan plaats totdat de niveaus in de armen uiteindelijk niet meer veranderen, wat aangeeft dat een evenwicht is bereikt. De osmotische druk (\(\Pi\)) van de glucoseoplossing is het verschil in druk tussen de twee zijden, in dit geval de hoogten van de twee kolommen. Hoewel het semipermeabele membraan watermoleculen in beide richtingen doorlaat, is de stroomsnelheid in beide richtingen niet gelijk omdat de concentratie water in de twee armen niet gelijk is. De nettostroom van water door het membraan kan worden voorkomen door op de rechterarm een druk uit te oefenen die gelijk is aan de osmotische druk van de glucoseoplossing.
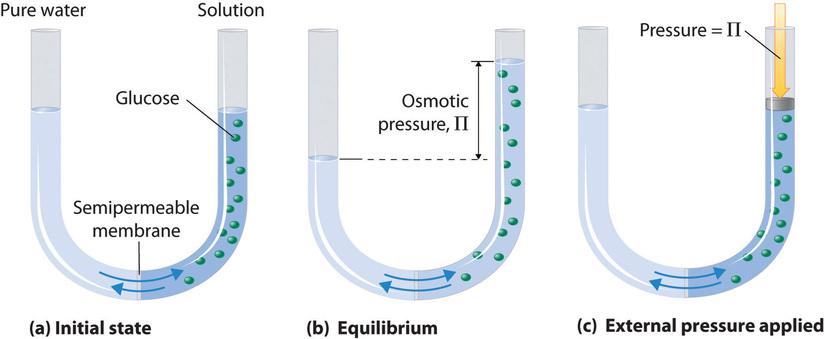
De osmotische druk van een oplossing hangt af van de concentratie van opgeloste opgeloste deeltjes. De osmotische druk volgt een wet die lijkt op de ideale gasvergelijking:
waar
- (M) is het aantal mol opgeloste deeltjes per volume-eenheid van de oplossing (d.w.z, de molariteit van de oplossing),
- (R) is de ideale gasconstante, en
- (T) is de absolute temperatuur.
Zoals in voorbeeld
(Pagina-index{1}) wordt aangetoond, kan de osmotische druk vrij hoog zijn, zelfs bij tamelijk verdunde oplossingen.
Voorbeeld
(Pagina-index{1}): Gistcellen
Wanneer bepaalde gisten in een geconcentreerde zoutoplossing worden geplaatst, kunnen zij hoge interne concentraties glycerol produceren om de osmotische druk van het omringende medium tegen te gaan. Stel dat de gistcellen in een waterige oplossing worden geplaatst die 4,0% massaprocent NaCl bevat; de dichtheid van de oplossing is 1,02 g/mL bij 25°C.
Bereken de osmotische druk van een 4,0% waterige NaCl-oplossing bij 25°C.
Als de normale osmotische druk in een gistcel 7,3 atm is, wat overeenkomt met een totale concentratie opgeloste deeltjes van 0,30 M, welke concentratie glycerol moeten de cellen dan synthetiseren om de externe osmotische druk bij 25°C precies in evenwicht te houden?
Gegeven: concentratie, dichtheid, en temperatuur van de \(NaCl})-oplossing; interne osmotische druk van de cel
Vraag: osmotische druk van de \(NaCl})-oplossing en concentratie van de benodigde glycerol
Strategie:
- Bereken de molariteit van de \(NaCl)-oplossing met behulp van de formulemassa van het oplosmiddel en de dichtheid van de oplossing. Bereken vervolgens de totale concentratie van de opgeloste deeltjes.
- Gebruik vergelijking \ref{eq1} om de osmotische druk van de oplossing te berekenen.
- Trek de normale osmotische druk van de cellen af van de osmotische druk van de zoutoplossing om de extra druk te verkrijgen die nodig is om de twee in evenwicht te brengen. Gebruik vergelijking \ref{eq1} om de molariteit van glycerol te berekenen die nodig is om deze osmotische druk op te wekken.
Oplossing:
A De oplossing bevat 4,0 g \(NaCl) per 100 g oplossing. Met behulp van de formulemassa van NaCl (58,44 g/mol) en de dichtheid van de oplossing (1,02 g/mL), kunnen we de molariteit berekenen:
&=(4,0 g NaCl}{58.44; \cancel{g}/mol; NaCl}rechts)\left(\dfrac{1}{100; \cancel{g};oplossing}}rechts)\left(\dfrac{1.02; \cancel{g; oplossing}{1.00; \cancel{mL}; oplossing}}{1;L}}rechts)\left(\dfrac{1000; \cancel{mL}}{1;L}} &= 0.70; M; NaCl \eind{align}
Omdat 1 mol NaCl 2 mol deeltjes in oplossing oplevert, is de totale concentratie opgeloste deeltjes in de oplossing (2)(0.70 M) = 1,4 M.
B Nu kunnen we met behulp van Vergelijking \ref{eq1} de osmotische druk van de oplossing berekenen:
&&= 34 atm [einde]
C Als de gistcellen de externe osmotische druk precies in evenwicht willen houden, moeten ze genoeg glycerol produceren om een extra interne druk van (34 atm – 7,3 atm) = 27 atm te geven. Glycerol is een niet-elektrolyt, dus kunnen we vergelijking \ref{eq1} oplossen voor de molariteit die overeenkomt met deze osmotische druk:
&= \dfrac{27; \cancel{atm}}{ (298 \;\cancel{K})}
Bij het oplossen van dit probleem hadden we ook kunnen inzien dat de osmotische druk in de cellen en in de oplossing alleen gelijk kan zijn als de concentraties van de opgeloste deeltjes gelijk zijn. We hebben berekend dat de normale concentratie van opgeloste deeltjes in de cellen 0,3 M is, en we hebben berekend dat de oplossing 1,4 M opgeloste deeltjes bevat. De gistcellen moeten dus voldoende glycerol synthetiseren om de interne concentratie van opgeloste deeltjes te verhogen van 0,3 M tot 1,4 M – dat wil zeggen een extra glycerolconcentratie van 1,1 M.
Oefening \(\PageIndex{1})
Aanname dat de vloeistoffen in een worstje ongeveer 0,80 M aan opgeloste deeltjes bevatten als gevolg van het zout en natriumnitriet dat is gebruikt om ze te bereiden. Bereken de osmotische druk in de worst bij 100°C om te weten te komen waarom ervaren koks het semipermeabele vel van worsten doorprikken alvorens ze te koken.
Antwoord: 24 atm
Omdat osmotische drukken zo groot zijn, is osmose buitengewoon belangrijk in de biochemie, biologie en geneeskunde. Vrijwel elke barrière die een organisme of cel scheidt van zijn omgeving werkt als een semi-permeabel membraan, dat de stroom van water maar niet van oplosmiddelen toelaat. Hetzelfde geldt voor de compartimenten binnen een organisme of cel. Sommige gespecialiseerde barrières, zoals die in uw nieren, zijn iets doorlaatbaarder en maken gebruik van een verwant proces, dialyse genaamd, dat zowel water als kleine moleculen doorlaat, maar geen grote moleculen zoals eiwitten.
Hetzelfde principe wordt al lang gebruikt om fruit en zijn essentiële vitamines gedurende de lange winter te bewaren. In jam en gelei worden hoge suikerconcentraties gebruikt, niet alleen voor de zoetheid, maar ook omdat daardoor de osmotische druk sterk toeneemt. Zo worden bacteriën die niet tijdens het kookproces worden gedood, gedehydrateerd, waardoor zij zich niet kunnen vermenigvuldigen in een anders rijk medium voor bacteriële groei. Een soortgelijk proces met zout voorkomt dat bacteriën groeien in ham, spek, gezouten varkensvlees, gezouten kabeljauw en andere geconserveerde vleessoorten. Het effect van osmotische druk wordt op dramatische wijze geïllustreerd in figuur
ageIndex{2}, die laat zien wat er gebeurt als rode bloedcellen in een oplossing worden geplaatst waarvan de osmotische druk veel lager of veel hoger is dan de interne druk van de cellen.

Naast capillaire werking gebruiken bomen osmotische druk om water en andere voedingsstoffen van de wortels naar de bovenste takken te transporteren. Verdamping van water uit de bladeren leidt tot een plaatselijke verhoging van de zoutconcentratie, waardoor een osmotische druk ontstaat die water via de stam van de boom naar de bladeren trekt.
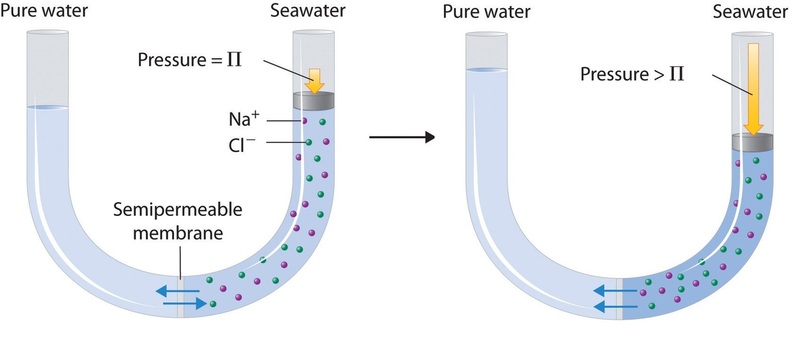
Ten slotte kan een proces dat omgekeerde osmose wordt genoemd, worden gebruikt om zuiver water uit zeewater te produceren. Zoals in figuur schematisch is weergegeven, worden watermoleculen door hoge druk op zeewater gedwongen door een halfdoorlatend membraan te stromen dat zuiver water van de oplossing scheidt, waarbij het opgeloste zout achterblijft. Grootschalige ontziltingsinstallaties die honderdduizenden liters zoet water per dag kunnen produceren, zijn gebruikelijk in de woestijngebieden van het Midden-Oosten, waar zij een groot deel van het voor de bevolking benodigde zoetwater leveren. Soortgelijke installaties worden nu gebruikt voor de zoetwatervoorziening in Zuid-Californië. Kleine, met de hand bediende omgekeerde osmose-installaties kunnen ongeveer 5 liter zoet water per uur produceren, genoeg om 25 mensen in leven te houden, en behoren nu tot de standaarduitrusting van reddingsboten van de Amerikaanse marine.
Samenvatting
Wanneer een oplossing en een zuiver oplosmiddel van elkaar worden gescheiden door een semipermeabel membraan, een barrière die wel moleculen van oplosmiddelen maar geen moleculen van oplosmiddelen doorlaat, is de stroom van oplosmiddelen in tegengestelde richtingen ongelijk en ontstaat er een osmotische druk, dat is het drukverschil tussen de twee kanten van het membraan. Osmose is de nettostroom van oplosmiddel door een dergelijk membraan als gevolg van verschillende concentraties van oplosmiddelen. Bij dialyse wordt gebruik gemaakt van een semipermeabel membraan met poriën die alleen kleine moleculen van oplosmiddelen en oplosmiddelen doorlaten.